4月28日,我系曾杰课题组与电子科技大学材料与能源学院的夏川课题组、中国科学院深圳先进技术研究院合成生物学研究所于涛课题组合作,在Nature Catalysis发表了题为“Upcycling CO2into energy-rich long-chain products via electrochemical and metabolic engineering”的文章。该工作首先通过电催化将二氧化碳和水合成高纯乙酸,再以乙酸及乙酸盐为碳源经生物发酵合成葡萄糖和脂肪酸等长碳链分子。在该研究中,曾杰为共同通讯作者。

随着新能源发电的迅速崛起,电力成本下降,电合成技术已经具备与依赖化石能源的传统化工工艺竞争的潜力。其中,二氧化碳电还原技术使用清洁电能将温室气体二氧化碳转化为高附加值化学品,对缓解资源短缺具有重大意义。但目前对二氧化碳电还原技术的研究大多局限于一碳和二碳等小分子产物,如何高效、可持续地将二氧化碳转化为富含能量的碳基长链分子仍然是一个巨大的挑战。
为了规避二氧化碳电还原的产物局限性,可考虑将二氧化碳电还原过程与生物过程相耦合,以电催化产物作为电子载体供微生物后续发酵合成长碳链的化学产品用于生产和生活。而选择合适的电子载体对微生物发酵至关重要。由于二氧化碳电还原的气相产物均难溶于水,生物利用效率低,因此优先选择二氧化碳电还原的液相产物作为生物发酵的电子载体。其中,乙酸是一种优秀的生物合成碳源,可以经发酵转化为葡萄糖等其他生物物质。
直接电催化转化二氧化碳到乙酸存在着反应速率慢、产物选择性低和碱溶液吸收等诸多问题。鉴于一步法电解的局限性,研究人员提出两步法电解的解决方案,即通过催化剂条件优化和反应器设计,先将二氧化碳高效转化为一氧化碳中间体,再基于固态电解质反应器通过晶界铜催化剂高选择性地合成纯乙酸。乙酸作为优秀的生物合成碳源之一,在细胞体内能有效地转化为乙酰辅酶A进入中枢代谢,通过糖异生、脂肪酸合成等通路实现碳链延伸,合成C6-C18等一系列长链多碳化合物。如图1所示,研究人员将电催化-生物合成结合,且使用巧妙的空间解偶联方式达成电催化上游合成底物,生物合成下游产物转化延伸,实现了“用二氧化碳和水合成葡萄糖和脂肪酸”的全过程。
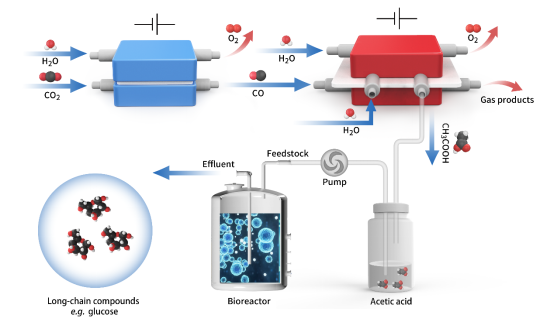
图1体外二氧化碳人工合成高能长链食品分子示意图
精确控制C1分子实现C-C偶联合成特定C2化合物是当前电催化合成的难点。研究人员发现电催化C1分子合成乙酸特异性地受催化剂表面几何结构影响,并通过理论模拟发现晶界结构能有效提高C1分子转化效率。首先,研究人员利用Ni-N-C单原子催化二氧化碳形成一氧化碳中间体,其法拉第效率近100%[1]。然后将收集的一氧化碳经脉冲电化学还原工艺形成的晶界铜催化合成乙酸。在气体扩散流动池中,乙酸盐法拉第效率最高可达52%;最高偏电流密度可达321毫安每平方厘米,此时乙酸盐法拉第效率仍保持在46%。为降低液体产物与电解质溶液及相关副产物分离成本和方便产物乙酸的下游利用,研究人员进一步开发了多孔固态电解质反应器[2],使阴极得到的乙酸根与阳极得到的氢离子结合形成高纯乙酸水溶液,无须分离提纯可直接用于下游生物发酵。通过新型电解装置测试,催化剂可在250毫安每平方厘米偏电流密度条件连续140小时制得纯度为97%的乙酸水溶液,从而解决了电合成过程中“浓度”与“纯度”两个关键难点。如图2所示。
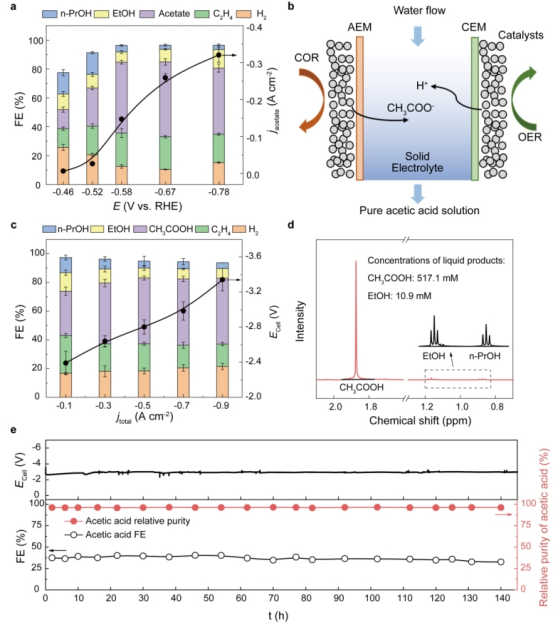
图2晶界铜催化CO还原合成乙酸
随后,研究人员将电合成得到的高纯乙酸溶液投喂给酿酒酵母,以期通过酵母的代谢工程进一步合成出葡萄糖等食品分子。为此,研究人员对酿酒酵母进行了基因编辑。酿酒酵母中,乙酰辅酶进入乙醛酸循环合成草酰乙酸经糖异生途径形成葡萄糖-6-磷酸。研究人员将酿酒酵母中三个己糖激酶(Glk1、Hxk1、Hxk2)敲除,废除酿酒酵母菌株利用葡萄糖能力,同时获得葡萄糖“泄露”表型。如图3所示,敲除三个己糖激酶后,工程菌株在摇瓶发酵条件下,葡萄糖产量为1.7 g/L。之后,继续敲除两个假定己糖激酶(YLLR446W, EMI2),同时过表达来自泛菌属的葡萄糖磷酸酶基因agpP和大肠杆菌的HAD4(haloacid dehalogenase-like phosphatase 4)基因yhix,葡糖糖产量达2.2 g/L,产量提高30%。
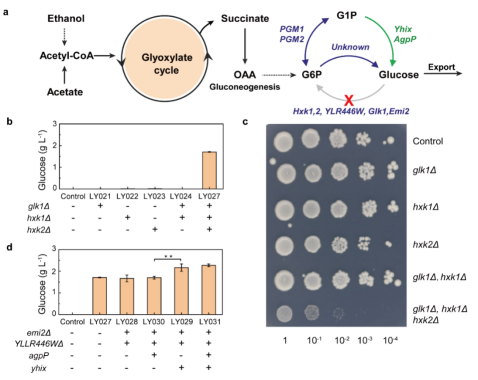
图3酿酒酵母菌株工程改造
研究人员分别以电催化合成乙酸及乙酸盐为唯一碳源,分批补料添加方式,利用产糖酿酒酵母合成葡萄糖,如图4所示,乙酸盐和乙酸为碳源分别合成葡萄糖1.8 g/L, 1.5 g/L。
游离脂肪酸是一类C8-C18组成的长链多碳化合物总称,因其在生产油脂化学品和生物燃料生产方面的潜在用途而受到广泛关注[3]。目前有关游离脂肪酸生产研究主要以葡萄糖为底物,研究人员以电催化合成乙酸为底物,在构建的产脂肪酸菌株中合成脂肪酸,合成脂肪酸含量检测可达448.5 mg/L,不同碳链长度脂肪酸含量如图4所示。

图4以乙酸盐及乙酸为碳源合成葡萄糖及脂肪酸
此项工作得到国家重点研发计划项目、国家自然科学基金项目、安徽省面上攻关、四川省中央引导地方-自由探索项目、电子科技大学启动基金以及深圳合成生物学创新研究院的支持。
文章链接:https://www.nature.com/articles/s41929-022-00775-6
